Possedere un formulario di chimica inorganica agile, facilmente consultabile è di fondamentale importanza per la pratica dell’attività del geologo specializzato.
Coefficienti stechiometrici e bilanciamento
Bisogna considerare una reazione chimica come un’equazione dove i coefficienti stechiometrici rappresentano i fattori moltiplicativi.
Per bilanciare una reazione è opportuno seguire i seguenti criteri:
- si pareggiano inizialmente gli atomi di elementi che compaiono in un minor numero di specie chimiche (in genere ossigeno e l’idrogeno sono molto diffusi e si bilanciano rispettivamente per ultimo (O) e penultimo (H))
- se, bilanciando un elemento, si modifica qualche altro elemento, si procede subito al suo bilanciamento
Esempio
Bilanciamo la seguente reazione
Fe2(CO3)3 + HNO3 ⇄ Fe(NO3)3 + H2CO3
1) bilanciamo il Fe:
Moltiplichiamo per 2 il nitrato ferrico Fe(NO3)3
Fe2(CO3)3 + HNO3 ⇄ 2Fe(NO3)3 + H2CO3
[Fe ⇒ 2 = 2]
2) bilanciamo l’azoto
Moltiplichiamo per 6 l’acido nitrico HNO3
Fe2(CO3)3 + 6HNO3 ⇄ 2Fe(NO3)3 + H2CO3
[N ⇒ 6 = 6]
3) bilanciamo il carbonio.
Moltiplichiamo per 3 l’acido carbonico H2CO3
Fe2(CO3)3 + 6HNO3 ⇄ 2Fe(NO3)3 + 3H2CO3
[C ⇒ 9 = 9]
4) Verifichiamo se H e O siano bilanciati. [O ⇒ 9+18 = 18+9 ; H ⇒ 6 = 6]
Leggi stechiometriche
Conservazione della massa di Lavoisier (1789)
ΣpR = ΣpP
ΣpR somma dei pesi dei reagenti
ΣpP somma dei pesi dei prodotti
Legge delle proporzioni multiple (Dalton 1803), definite e costanti (Proust 1799)
In un determinato composto chimico gli elementi che lo formano stanno tra loro in proporzioni di peso definite e costanti. Quando due elementi si combinano tra loro per dare più di un composto, le quantità in peso di uno che si combinano con una quantità fissa dell’altro stanno tra loro in rapporti esprimibili mediante numeri interi, in genere piccoli.
Rapporti volumetrici gassosi definiti e costanti (Gay Lussac 1808)
I volumi delle specie chimiche gassose che partecipano ad una reazione stanno tra loro sempre in rapporto numerico semplice.
Principio di Avogadro e teoria atomico-molecolare (1811)
Volumi uguali di gas diversi nelle stesse condizioni di T e di P devono contenere lo stesso numero di particelle.
Massa e composizione atomica
Unità di massa atomica (U.M.A. o UM)
H = 1 UM
per confronto si possono ricavare le UM degli altri elementi
Oggi non si usa più l‟Idrogeno come unità di misura per pesare le sostanze, ma 1/12 della massa del 12C.
1 UM = 1,660538782 10-24 g
Utilizzando dunque come fattore di conversione (approssimato) 1,6605 10-24 g/u è possibile trasformare i pesi relativi (espressi in UM) in pesi assoluti (espressi in g).
pa (g) = pr (UM) 1,6605 10-24 (g/u) (peso atomico assoluto)
pr (peso relativo in UM)
Esempio il pa del 12C è paC = 12 (UM) 1,6605 10-24 (g/UM) = 1,9926 10-23 (g)
Numero atomico (Z) e numero di massa (A)
Z = Np+
Z (numero atomico)
Np+ (numero di protoni del nucleo)
A = Np++ Nn0 = Nnu
Np+ (numero di protoni del nucleo)
Nn0 oppure N (numero di neutroni nucleo)
Nnu (numero di nucleoni)
Relazioni fra A, Z ed N
A = Z + N
Notazioni di un elemento chimico (X)
La tavola periodica degli elementi normalmente riporta la seguente notazione per ciascun elemento
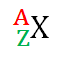
Isotopi, isòbari e isotoni
Gli isotopi Sono nuclidi di un medesimo elemento chimico (stesso Z) che differiscono per il numero N
Gli isobari hanno lo stesso numero di massa A, mentre gli isòtoni hanno lo stesso N
In realtà il peso atomico è la media ponderata (pesata) delle masse dei suoi isotopi. Ogni elemento
Peso atomico e peso molecolare
In realtà il peso atomico è la media ponderata (pesata) delle masse dei suoi isotopi. Ogni elemento chimico è presente in natura sotto forma di una miscela dei suoi isotopi, i quali sono però più o meno abbondanti e contribuiscono pertanto in maniera diversa al peso atomico dell‟elemento, in proporzione alla loro diffusione percentuale.
Peso atomico medio
Per calcolare il peso atomico medio dobbiamo dunque calcolare una media che tenga conto della loro diversa abbondanza.

I pesi atomici relativi che compaiono nella tabella periodica possono essere utilizzati per determinare i pesi molecolari relativi (nel caso di formule minime si parla di peso-formula).
Per determinare il peso molecolare relativo di una sostanza è sufficiente sommare i pesi atomici di tutti gli elementi che compaiono nella formula, ciascuno moltiplicato per il rispettivo indice.
Mole (M) e peso molare (pM)
La mole (M) è una quantità di una sostanza chimica numericamente uguale al suo peso relativo, espresso in g (o in Kg) anziché in unità di massa atomica.
1 M = pr [g]
Il peso molare (pM) di una sostanza è uguale al peso di 1 M
pM = p (1 M) [g/mol]
pr [UM] = pM [g/mol]

Il peso molare (pM) ed il peso molecolare relativo (pr) sono per definizione numericamente uguali per qualsiasi sostanza.
Numero di Avogadro
Una mole è una quantità di sostanza contenente un numero di Avogadro (NA) di entità costituenti, identiche e numerabili.

Coefficienti stechiometrici
I coefficienti stechiometrici rappresentano il numero di moli che reagiscono.
es. 3H2 + N2 → 2NH3 ossia 3 mole di H2 reagiscono con 1 mole di N2 per dre come prodotto di reazione 2 moli di NH3
per trasformare i coefficienti stechiometrici nell‟equivalente quantità in peso (p), è sufficiente moltiplicarli tutti per il rispettivo peso molare (pM)
3 pMH2 + 1 pMN2 → 2 pMNH3
3 ·2 + 1 · 2·(14) = 2 (14 + 3 · 1)
6g H2 + 28g N2 = 34g NH3
Composizione percentuale e formula di un composto
Nelle analisi chimiche di una sostanza di solito si ottengono dei dati sulla sua composizione, espressa come percentuale, di elementi chimici in essa presenti.
E’ possibile, nota la composizione percentuale di un composto, assegnargli una formula opportuna detta formula empirica o “bruta”. E’ possibile ovviamente fare il contrario, ossia nota la sua formula, determinare la percentuale in peso dei diversi elementi che lo compongono.
Dalla composizione in peso alla formula minima
Dalla composizione percentuale alla formula molecolare

Dalla formula alla composizione percentuale
1) Calcoliamo che percentuale di X1 è presente in un certo composto C.
Si calcola pMC
pMC = n1 pM X1 + n2 pM X2 + … (peso molecolare del composto C) [g/mole]
n1, n2, … (coefficienti stechiometrici presenti nella formula)
% X1 = (pM X1 / pMC ) · 100
Rapporti ponderali
Z (Na [numero atomico] = np+ [numero di protoni] = ne– [numero di elettroni] = n° ordine della tavola periodica)
pa = massa rapportata a 1/12 di C (per H = 1) (peso atomico)
pMC = Σ paj (peso molecolare)
pF (somma dei pa nei composti ionici – peso formula)
peq (quantità in peso che reagisce con 1 g di H – peso equivalente)
peq = pF / ne– (reazione di idrolisi)
peq = pM/ nH+ (reazione di neutralizzazione)
peq = pM/ ne– (reazione di ossidoriduzione)
Neq = pX (g) / Peq (numero di equivalenti)
1 M (mole) = NA (numero di Avogadro)
ga quantità in g ≡ Pa (grammoatomo)
gm quantità in g ≡ pM (grammolecola)
gf quantità in g ≡ pF (grammoformula)
nmol = pX [g] / pMX = g/pa = g/pMC = g/pF (numero di moli)
- M = nmolsolt / Vsol [n/l] = pX/pM · Vsol [g/pM l] (molarità – n di moli di soluto per litro di soluzione)
nmolsolt (numero di moli di soluto)
Vsol (volume di soluzione)
pX (peso di una sostanza X)
- F = pFsolt/Vsol ( formalità – numero di pF di soluto per litro di soluzione)
pFsolt (numero di peso formula di soluto)
- N = Ne / Vsol [n/l] = pX/peq · Vsol [g/peq ] (normalità – numero di equivalenti per litro di soluzione) normalità
- m = nmolsolt / pXsolv [n / Kg] (molalità – numero moli di soluto per Kg di solvente)
pXsol (peso di solvente)
Reazioni chimiche
Reazioni di ossido-riduzione (Reazioni redox)
n oppure nox (numero di ossidazione) Xn
Ossidazione (+) /Riduzione (-)
n0 → n0±n
n0 (numero di ossidazione iniziale)
n (numero che si aggiunge/viene perso rispetto al numero di ossidazione iniziale)
Un elemento chimico si ossida/riduce quando, durante una reazione, il suo numero di ossidazione aumenta/diminuisce. Una reazione di ossidazione comporta quindi un trasferimento di elettroni (e–).
Un atomo che si ossida/riduce, perde/acquista tanti elettroni quanti sono indicati dalla variazione del suo numero di ossidazione (Δn).
Per bilanciare una reazione redox è necessario porre davanti agli elementi che si ossidano/si riducono dei coefficienti tali da garantire l’eguaglianza tra il numero di e– persi ed il numero di e– acquistati (bilancio elettronico).
Le reazioni redox possono essere proposte in due modi: in forma molecolare o in forma ionica netta.
Strategia di bilanciamento delle reazioni redox in forma molecolare
- Verifica delle condizioni redox (almeno due elementi devono aver subito cambiamenti Δn
- è evidente quando un elemento X si trova da un lato della linea di reazione allo stato elementare (nox = 0) e dall’altro si trova legato all’interno di un composto (nox ≠ 0)
- negli altri casi casi è necessario calcolare i numeri di ossidazione, scrivendo i numeri di ossidazione variati in alto a destra dei rispettivi simboli degli elementi.
- Calcolo elettroni ceduti/acquistati
- si uniscono con un segmento a freccia finale gli atomi dell’elemento che si ossida e con un’altro uguale gli atomi dell’elemento che si riduce, individuando in tal modo le semireazioni di ossidazione e di riduzione.
- in corrispondenza di ciascun segmento si scrive il numero di e– persi ed acquistati, calcolato come prodotto tra la variazione (in aumento o in diminuzione) del numero di ossidazione (Δnox), ed il numero di atomi (indice) dell’elemento che reagisce.

Scrittura semireazioni e bilancio di massa
- si scrivono le due semireazioni di RED e di OX.
- vengono bilanciati gli elementi che si ossidano e che si riducono (bilancio di massa). Nel caso in cui il bilancio di massa implichi una variazione del coefficiente che precede un reagente è necessario moltiplicare per lo stesso numero anche gli e– trasferiti nella semireazione, aggiornando il numero di elettroni persi o acquistati.
ESEMPIO

è necessario aggiungere un 2 davanti a NH3 per bilanciare il valore di N nella semireazione 1.
![]()
aggiungiamo un 2 davanti ad H2O per bilanciare l’O e aggiorniamo a 4 gli e– persi durante la semireazione 2 di ossidazione (ogni molecola di H2O cede infatti 2 e–, 2 molecole H2O ne cedono 4)
![]()
Calcolo del rapporto di scambio elettronico e bilancio elettronico
Si calcola il rapporto di scambio elettronico tra la specie RED e quella OX (rapporto e– acquistati/e– ceduti). Nel caso dell’esempio il rapporto è 6/4 = 3/2. Si utilizza il numero trovato in una semireazione per moltiplicare l’altra (e viceversa) in modo che siano bilanciati (minimo comune multiplo) gli elettroni trasferiti (bilancio elettronico).

Sommando membro a membro le due semireazioni si ottiene infine la reazione bilanciata

N.B. in alcune reazioni REDOX si possono avere anche coefficienti frazionari
*** sezione in costruzione ***
(ultimo aggiornamento 5.11.2020 – 19:02)
In una dismutazione (o reazioni di ossidoriduzione interna) il trasferimento di elettroni avviene tra molecole di un medesimo composto. Un medesimo elemento è soggetto sia ad una riduzione che ad un‟ossidazione.
Nell’esempio che segue, alcune molecole di ipoclorito si riducono a cloruro, altre si ossidano a clorato



